В настоящее время костномозговая трансплантация широко используется в лечении различных форм лейкозов, лимфопролиферативных заболеваний, аплазий кроветворной ткани, многих форм наследственной патологии, включая метаболические нарушения, анемии, тяжелые иммунодефицитные состояния. Трансплантация костного мозга является эффективным способом восстановления гемопоэза после общего облучения. Первые успешные трансплантации костного мозга были выполнены между однояйцевыми близнецами. В 1968 г. в мире было выполнено 203 трансплантации аллогенного костного мозга. С 1979 г. по 1981 г. число реципиентов костного мозга возросло до 1825, при ежегодном выполнении от 400 до 875 трансплантаций. В 1982-1984 гг. было выполнено 6067 трансплантаций костного мозга. В 2001 году число трансплантаций в год составляло порядка 10000.
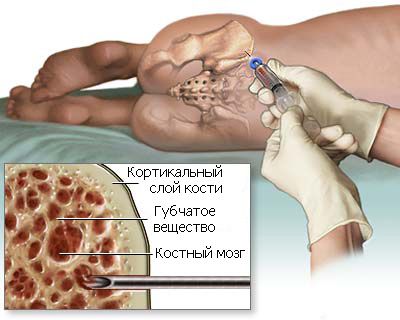
Доза кроветворных клеток, трансплантируемых в организм реципиента с заместительной целью, составляет не менее 5 × 108 – 1 × 109 на кг массы тела. Получают костный мозг от доноров путем аспирации грудины , подвздошной кости. Вводят костный мозг внутривенно.
Источником гемопоэтической ткани кроме костного мозга может быть эмбриональная печень.
Эти ткани содержат гемопоэтические стволовые клетки, которые способны приживать в организме реципиента и давать начало всем кроветворным росткам – эритроидному, гранулоцитарному, лимфоцитарному, моноцитарно-макрофагальному.
Среди видов трансплантации костного мозга наиболее благоприятной в иммунологическом отношении и терапевтически эффективной является аутотрансплантация, при которой в 100% случаев происходит приживление введенных клеток и не наблюдается иммунологических конфликтов между введенными клетками и реципиентом. По лечебной эффективности среди аллогенной гемопоэтической ткани первое место занимает донорский HLA- генетически идентичный костный мозг, полученный от однояйцевых близнецов или сибсов; второе место занимает гаплоидентичный HLA-совместимый костный мозг, полученный от родителей или братьев, третье место – клетки эмбриональной печени и четвертое место – донорский и трупный фенотипически HLA-совместимый костный мозг.
Возможность аутотрансплантации костномозговых клеток появилась с разработкой эффективных способов их криоконсервирования. В настоящее время аутотрансплантация используется при лечении лейкозов и лимфопролиферативных заболеваний, в лечении депрессий гемопоэза и лимфопоэза у лиц, получивших высокие дозы облучения и химиопрепаратов в курсе лечения солидных опухолей. В этих случаях костный мозг для трансплантации получают в период ремиссий до проведения радио- и химиотерапии. В перспективе аутотрансплантация костномозговых клеток может быть также использована в лечении ряда других заболеваний, в частности лучевой болезни, медикаментозно-резистентных форм депрессий гемопоэза, депрессий иммуногенеза, в интенсивной терапии критических ситуаций, реабилитации больных после сложных операций и политравм, больных, перенесших тяжелые инфекции. Для реализации данного подхода в терапии для каждого желающего может быть создан запас его собственной крови и костномозговых клеток в тканевом банке, который может быть использован в критических ситуациях.
В лечении больных гемобластозами, апластической анемией, с врожденными комбинированными иммунодефицитами высокий положительный эффект наблюдается от применения аллогенной гемопоэтической ткани.
Успех трансплантации гемопоэтической ткани и ее терапевтическая эффективность определяется:
1) степенью функциональной активности трансплантированных гемопоэтических клеток, от которой зависит их способность быстрой компенсации дефицита организма в клетках крови и скорость репопуляции кроветворной и лимфоидной ткани;
2) силой и характером реакции реципиента на трансплантат (РХПТ), а с другой стороны – трансплантата, который иммунокомпетентный, против реципиента (РТПХ), которые определяются, главным образом, степенью антигенной совместимости донора и реципиента. Для избежания иммунологического конфликта между трансплантируемой тканью и реципиентом проводят подбор пар донор-реципиент по основным антигенам системы HLA, определяют степень совместимости донорских и реципиентских лимфоцитов в смешанной культуре лимфоцитов, определяют наличие в сыворотке реципиента предсуществующих антител к донорским клеткам. Обязательным является подбор трансплантата по эритроцитарным антигенам системы АВО и резус-фактору. Необходимость подбора обусловлена риском развития острого или отсроченного гемолиза эритроцитов, а также возможностью задержки восстановления гемопоэза.
Важным моментом в предтрансплантационный подготовке больных является проведение курса иммуносупрессивной терапии. Обычно для этой цели используются азатиоприн и преднизолон. Больным лейкозами и лимфопролиферативными заболеваниями непосредственно перед трансплантацией костного мозга (помимо медикаментозных иммуносупрессивных препаратов) может рекомендоваться курс облучения лимфоидной ткани с целью подавления злокачественного процесса и элиминации опухолевых клеток, а также полного подавления иммунореактивности организма.
В послеоперационном периоде для подавления РТПХ и РХПТ назначают иммуносупрессивную терапию, обычно включающую циклофосфамид, циклоспорин А, кортикостероиды – преднизолон, антилимфоцитарный гаммаглобулин.
Развитие РХПТ неизбежно ведет к отторжению трансплантата. Отторжение трансплантата может быть немедленным, без проявления каких-либо признаков его функционирования, или отсроченным, развивающимся после периода его начального функционирования. О его отторжении свидетельствует развитие костномозговой аплазии, уменьшение количества клеток в крови и пунктате костного мозга. Реакция хозяин против трансплантата опосредуется радиорезистентными цитотоксическими Т-лимфоцитами и НК-лимфоцитами, которые в результате прямого цитотоксического действия вызывают цитолизис трансплантированных гемопоэтических элементов, а также подавляют их трансформацию в зрелые клетки крови.
Серьезным осложнением костномозговой трансплантации является реакция трансплантат против хозяина, которая может иметь острое и хроническое течение и приводить к GVH-болезни, которая, как правило, заканчивается летально. Клинически болезнь проявляется симптомами поражения кожи, желудочно-кишечного тракта, печени и органов кроветворения. У больных наблюдается нетипичная эритема кожи с перерастанием в генерализованную эритродермию, тошнота, рвота, боли в желудке, понос с примесью крови, симптомы кишечной непроходимости, увеличение печени и болезненность ее при пальпации, спленомегалия и увеличение лимфоузлов. В сыворотке определяются высокие значения билирубина, щелочной фосфатазы, аминотрансферазы. В крови выявляется низкое содержание эритроцитов, лейкоцитов, тромбоцитов. Клеточность костного мозга, селезенки, лимфоузлов достигает критических значений. Наблюдаемые проявления болезни являются результатом цитотоксического действия донорских Т-лимфоцитов в отношении тканей реципиента. GVH-болезнь наблюдается в 50-70% случаев трансплантации HLA-совместимого аллогенного костного мозга. Для профилактики острой GVH-болезни костномозговой трансплантат подвергают Т-клеточному истощению. В свою очередь, удаление Т-лимфоцитов из костного мозга приводит к уменьшению процента случаев его приживления, увеличению частоты рецидивов основного заболевания (например, лейкозов), замедлению восстановления иммунореактивности организма и, как следствие, к повышению частоты инфекционных осложнений.
Другим серьезным осложнением костномозговой трансплантации является развитие бактериальных и вирусных инфекций, трудно поддающихся лечению. Их развитие связано с низкой иммунореактивностью организма в посттрансплантационный период. Часто именно инфекционные поражения организма реципиента являются основной причиной его смерти.
В случае приживления костномозгового трансплантата наблюдается полное восстановление кроветворения и иммунореактивности организма. Трансплантация костного мозга позволяет в настоящее время сохранить жизнь многим тысячам людей, страдающих самой различной патологией.